FORMACIÓN DE LA ORINA POR LOS RIÑONES:II.REABSORCIÓN Y SECRECIÓN TUBULAR
A medida que el filtrado glomerular pasa por los túbulos renales, fluye de forma secuencial a través de sus diferentes partes (el túbulo proximal, el asa de Henle, el túbulo distal, el túbulo colector y, finalmente, el conducto colector) antes de eliminarse por la orina. A lo largo de este recorrido, algunas sustancias se reabsorben selectivamente en los túbulos volviendo a la sangre, mientras que otras se secretan desde la sangre a la luz tubular. Finalmente, la orina ya formada y todas las sustancias que contiene representan la suma de los tres procesos básicos que se producen en el riñón (la filtración glomerular, la reabsorción tubular y la secreción tubular): Excreción urinaria = Filtración glomerular − Reabsorción tubular + Secreción tubular. la reabsorción tubular desempeña un papel importante en lo que se refiere a su excreción final por la orina.La secreción tubular es responsable de las cantidades significativas de iones potasio e hidrógeno y de algunas otras sustancias que aparecen en la orina.

LA REABSORCIÓN TUBULAR ES CUANTITATIVAMENTE IMPORTANTE Y ALTAMENTE SELECTIVA .
Manejo renal de algunas sustancias que se filtran libremente en los riñones y que se reabsorben en cantidades variables. La intensidad con la que cada una de estas sustancias se filtra se calcula así: Filtración = Filtrado glomerular × Concentración plasmática. Cuando se hace este cálculo, se supone que la sustancia se filtra libremente y que no está unida a las proteínas del plasma.


LA REABSORCIÓN TUBULAR COMPRENDE MECANISMOS PASIVOS Y ACTIVOS
Para que una sustancia se reabsorba, primero debe ser transportada: 1) a través de las membranas del epitelio tubular hasta el líquido intersticial renal y luego 2) a través de la membrana capilar peritubular hasta la sangre.
La reabsorción a través del epitelio tubular hacia el líquido intersticial se efectúa me diante un transporte activo y pasivo y por los mismos mecanismos básicos para el transporte a través de otras membranas del cuerpo. Por ejemplo, el agua y los solutos pueden ser transportados bien a través de las propias membranas celulares (vía transcelular) o a través de los espacios que existen entre las uniones celulares (vía paracelular). Luego, una vez producida la reabsorción a través de las células epiteliales tubulares hasta el líquido intersticial, el agua y los solutos son transportados a través de las paredes de los capitales peritubulares para pasar a la sangre por ultrafiltración (mayor parte del flujo), que está mediado por fuerzas hidrostáticas y coloidosmóticas. Los capilares peritubulares se comportan de forma muy parecida a las terminaciones venosas porque existe una fuerza de reabsorción neta que mueve el líquido y los solutos desde el intersticio a la sangre.
TRANSPORTE ACTIVO
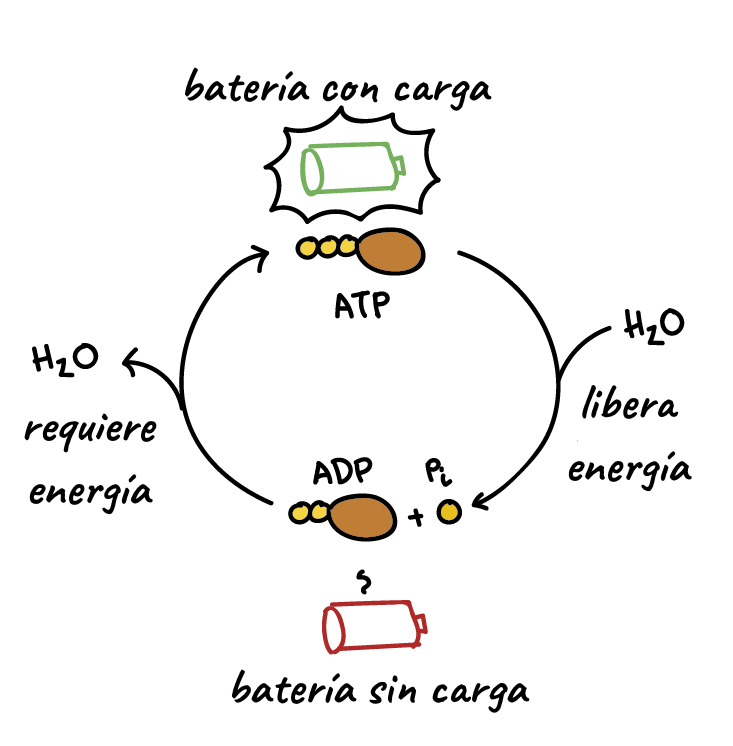
El transporte activo puede mover un soluto en contra de un gradiente electroquímico y para ello precisa energía del metabolismo. El transporte que está acoplado directamente a una fuente de energía, como la hidrólisis del trifosfato de adenosina (ATP), se llama transporte activo primario. Un buen ejemplo de esto es la bomba ATPasa sodiopotasio que funciona en los tramos del túbulo renal. El transporte que está acoplado indirectamente a una fuente de energía, como el debido a un gradiente de iones, se conoce como transporte activo secundario. La reabsorción de glucosa por el túbulo renal es un ejemplo de transporte activo secundario. Aunque los solutos pueden reabsorberse en el túbulo por mecanismos activos y pasivos, el agua siempre se reabsorbe por un mecanismo físico pasivo (no activo) llamado ósmosis, que significa difusión de agua desde una zona de baja concentración de solutos (alta concentración de agua) a otra de concentración alta de solutos (baja concentración de agua).

LOS SOLUTOS PUEDEN TRANSPORTARSE A TRAVÉS DE LAS CÉLULAS EPITELIALES O ENTRE CELULAS.
Las células tubulares renales se mantienen juntas por medio de uniones estrechas. Los espacios intercelulares laterales están situados por detrás de estas uniones estrechas y separan las células epiteliales del túbulo. Los solutos pueden reabsorberse o secretarse a través de las células por vía transcelular o entre las células moviéndose a través de las uniones estrechas y los espacios intercelulares siguiendo la vía paracelular. El sodio es una sustancia que se desplaza por las dos vías, aunque la mayor parte lo hace a través de la vía transcelular. En algunos segmentos de la nefrona, especialmente en el túbulo proximal, el agua se reabsorbe también a través de la vía paracelular, y las sustancias disueltas en el agua, se transportan junto al líquido que se reabsorbe entre las células.

El TRANSPORTE ACTIVO PRIMARIO A TRAVÉS DE LA MEMBRANA TUBULAR ESTÁ ACOPLADO A LA HIDRÓLISIS DEL ATP
La importancia especial del trasporte activo primario es que puede mover los solutos en contra de un gradiente electroquímico. La energía necesaria para este transporte activo procede de la hidrólisis del ATP que realiza la ATPasa unida a la membrana; la ATPasa es también un componente del mecanismo de transporte que liga y mueve solutos a través de las membranas celulares. Los transportadores activos primarios en los riñones que conocemos son la ATPasa sodiopotasio, la ATPasa hidrógeno, la ATPasa hidrógenopotasio y la ATPasa calcio. Un buen ejemplo de un sistema de transporte activo primario es la reabsorción de iones sodio a través de la membrana tubular proximal.

En las superficies basolaterales de la célula epitelial tubular, la membrana celular tiene un amplio sistema de ATPasa sodiopotasio que hidroliza al ATP y utiliza la energía liberada para transportar los iones sodio desde el interior de la célula hasta el intersticio. Al mismo tiempo, el potasio pasa desde el intersticio al interior de la célula. El funcionamiento de esta bomba de iones mantiene una concentración intracelular de sodio baja y una concentración intracelular de potasio alta y genera una carga negativa neta de unos –70 mV dentro de la célula. Este bombeo activo de sodio de la célula a través de su membrana basolateral favorece la difusión pasiva del sodio a través de la membrana luminal de la célula, desde la luz tubular al interior de la célula por dos razones: 1) existe un gradiente de concentración que favorece la difusión del sodio hacia el interior de la célula. 2) el potencial intracelular negativo, de –70 mV, atrae a los iones sodio positivos que se encuentran en la luz tubular hacia el interior de la célula.
La reabsorción activa del sodio mediante la ATPasa sodiopotasio tiene lugar en la mayor parte del túbulo. En el túbulo proximal hay un borde en cepillo extenso en el lado luminal de la membrana. También existen proteínas transportadoras del sodio, que fijan los iones en el lado luminal de la membrana y lo liberan dentro de la célula, lo que constituye una difusión facilitada del sodio a través de la membrana hacia el interior de la célula. Estas proteínas transportadoras son importantes para el transporte activo secundario de sustancias, como la glucosa y los aminoácidos, Así pues, la reabsorción neta de los iones sodio desde la luz tubular hacia la sangre supone al menos tres pasos: 1. El sodio se difunde a través de la membrana luminal (también llamada membrana apical) al interior de la célula siguiendo un gradiente electroquímico creado por la bomba ATPasa sodiopotasio. 2. El sodio es transportado a través de la membrana basolateral contra un gradiente electroquímico por la acción de la bomba ATPasa sodiopotasio. 3. El sodio, el agua y otras sustancias se reabsorben del líquido intersticial hacia los capilares peritubulares por ultrafiltración, un proceso pasivo gobernado por gradientes de presión hidrostática y coloidosmótica.

REABSORCIÓN ACTIVA SECUNDARIA A TRAVÉS DE LA MEMBRANA TUBULAR
En el transporte activo secundario, dos o más sustancias se ponen en contacto con una determinada proteína de la membrana (una molécula transportadora) y ambas atraviesan juntas la membrana. Cuando una sustancia (p. ej., el sodio) difunde a favor de su gradiente electroquímico, la energía liberada se utiliza para que otra sustancia
(p. ej., la glucosa) pase en contra de su gradiente electroquímico. De este modo, el transporte activo secundario no precisa energía que proceda directamente del ATP o de otras fuentes de fosfatos de alta energía. Por el contrario, la fuente directa de energía es la liberada por la difusión facilitada simultánea de otra sustancia transportada a favor de su propio gradiente electroquímico.

En ambos casos, existen proteínas transportadoras específicas en el borde en cepillo que se combinan con un ion sodio y con un aminoácido o una molécula de glucosa al mismo tiempo. Estos mecanismos de transporte son tan eficientes que eliminan prácticamente toda la glucosa y los aminoácidos de la luz tubular. Una vez dentro de la célula, la glucosa y los aminoácidos salen a través de las membranas basolate rales por difusión facilitada, gobernada por las elevadas concentraciones de glucosa y aminoácidos en la célula facilitados por proteínas transportadoras específicas. Los cotransportadores de glucosa y sodio (SGLT2 y SGLT1) están situados en el borde en cepillo de las células tubulares proximales y llevan glucosa al citoplasma celular en contra de un gradiente de concentración, como se ha descrito antes. Aproximadamente el 90% de la glucosa filtrada es reabsorbido por SGLT2 en la primera parte del túbulo proximal (segmento S1) y el 10% residual es transportado por SGLT1 en los segmentos posteriores del túbulo proximal
SECRECIÓN ACTIVA SECUNDARIA HACIA LOS TÚBULOS
Algunas sustancias se secretan en los túbulos mediante un transporte activo secundario. Esto supone a menudo un contratransporte de la sustancia junto a iones sodio. En el contratransporte, la energía liberada por el desplazamiento a favor de la corriente de una de las sustancias (p. ej., los iones sodio) permite el paso a contracorriente de una segunda sustancia en dirección opuesta, es la secreción activa de iones hidrógeno acoplada a la reabsorción de sodio en la membrana luminal del túbulo proximal.La entrada del sodio en la célula se combina con la expulsión de hidrógeno de la célula gracias al contratransporte sodiohidrógeno. Este transporte está mediado por una proteína específica (intercambiador de sodiohidrógeno) que se encuentra en el borde en cepillo de la membrana luminal. Conforme el sodio es transportado al interior de la célula, los iones hidrógeno son obligados a salir en dirección contraria hacia la luz tubular

PINOCITOSIS: UN MECANISMO DE TRANSPORTE ACTIVO PARA REABSORBER PROTEÍNAS
Algunas partes del túbulo, especialmente del túbulo proximal, reabsorben moléculas grandes, como las proteínas, por pinocitosis. En este proceso, la proteína se une al borde en cepillo de la membrana luminal y, seguidamente, esta porción de la membrana se invagina hacia el interior de la célula hasta que forma una vesícula que contiene la proteína. Una vez dentro de la célula, la proteína se digiere en sus aminoácidos, que se reabsorben a través de la membrana basolateral hacia el líquido intersticial. Como la pinocitosis necesita energía, se considera una forma de transporte activo.

TRANSPORTE MÁXIMO DE SUSTANCIAS QUE SE REABSORBEN DE FORMA ACTIVA
Las sustancias que se reabsorben o excretan activamente tienen un límite en la intensidad con la que pueden transportarse, denominado transporte máximo. Este límite se debe a la saturación de los sistemas de transporte específicos cuando la cantidad de soluto que llega al túbulo (denominada carga tubular) supera la capacidad de las proteínas transportadoras y enzimas específicas implicadas en el proceso de transporte. El sistema de transporte de la glucosa en el túbulo proximal es un buen ejemplo. Normalmente no aparece glucosa medible en la orina porque casi toda la glucosa filtrada se reabsorbe en el túbulo proximal. Pero cuando la carga filtrada supera la capacidad de los túbulos de reabsorber la glucosa, se produce la excreción de glucosa en la orina.El exceso de glucosa filtrada no se reabsorbe y pasa a la orina.
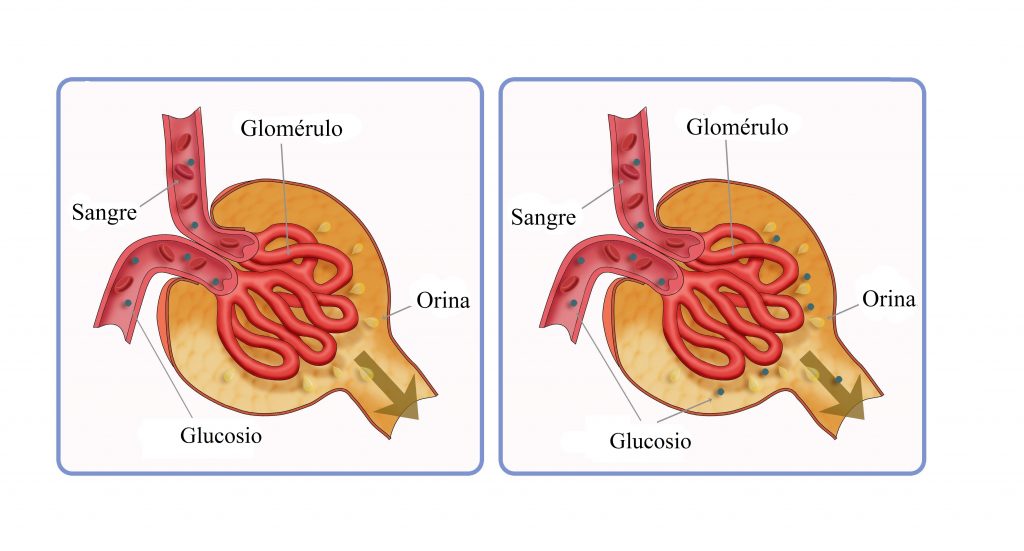
SUSTANCIAS QUE SE TRANSPORTAN DE FORMA ACTIVA PERO NO EXHIBEN TRANSPORTE MÁXIMO
La razón de que solutos con trasporte activo muestren a menudo un transporte má ximo es que el sistema transportador se satura a medida que
la carga tubular aumenta. Algunas sustancias que se reabsorben de forma pasiva no muestran un transporte máximo porque la intensidad de su transporte está determinada por otros factores, como: 1) el gradiente electroquímico para la difusión de la sustancia a través de la membrana; 2) la permeabilidad de la membrana para la sustancia, y 3) el tiempo que el líquido que contiene la sustancia permanece dentro del túbulo. Al transporte de este tipo se le denomina transporte de gradientetiempo porque la intensidad del transpor te depende del gradiente electroquímico y del tiempo que la sustancia está en el túbulo, lo que a su vez depende del flujo tubular. Algunas sustancias con transporte activo también tienen características de transporte gradientetiempo. Un ejemplo es la reabsorción de sodio en el túbulo proximal. La principal razón de que el transporte de sodio en el túbulo proximal no muestre un transporte máximo es que otros factores limitan la reabsorción junto a la intensidad máxima de transporte activo. Por ejemplo, en los túbulos proximales la capacidad de transporte máximo de la bomba ATPasa sodiopotasio basolateral suele ser mucho mayor que la intensidad real de la reabsorción neta de sodio. Una de las razones de esto es que una cantidad significativa de sodio transportado fuera de la célula vuelve a la luz tubular a través de las uniones epiteliales estrechas. La intensidad de este flujo retrógrado depende de varios factores, como: 1) la permeabilidad de las uniones estrechas y 2) las fuerzas físicas intersticiales, que determinan la intensidad de la reabsorción del flujo en masa desde el líquido intersticial hasta los capilares peritubulares. Luego el transporte del sodio en los túbulos proximales obedece sobre todo a los principios del transporte gradientetiempo en lugar de a las características del transporte tubular máximo. Esto significa que cuanto mayor sea la concentración de sodio en los túbulos proximales, mayor será su reabsorción. Además, cuanto más lento sea el flujo de líquido tubular, mayor será el porcentaje de sodio que puede reabsorberse de los túbulos proximales. En las partes más distales de la nefrona, las células epiteliales tienen más uniones estrechas y transportan mucho menos sodio. En estos segmentos, la reabsorción del sodio muestra un transporte máximo similar al de otras sustancias con un transporte activo. Además, este transporte máximo puede aumentar por la acción de ciertas hormonas, como la aldosterona.
REABSORCIÓN DE CLORO,UREA Y OTROS SOLUTOS POR DIFUSIÓN PASIVA
Cuando se reabsorbe el sodio a través de la célula epitelial tubular, se transportan iones negativos como el cloro junto al sodio debido a los potenciales eléctricos.Esto hace que los iones cloro difundan pasivamente a través de la vía paracelular. Se produce una reabsorción adicional de iones cloro por un gradiente de concentración de cloro que se forma cuando el agua se reabsorbe del túbulo por ósmosis, lo que concentra los iones cloro en la luz tubular .Por tanto, la reabsorción activa de sodio está muy bien acoplada a la reabsorción pasiva de cloro a través de un potencial eléctrico y un gradiente de concentración de cloro. Los iones cloro pueden reabsorberse también mediante un transporte activo secundario. El más importante de los procesos activos secundarios para la reabsorción del cloro consiste en el cotransporte del cloro con el sodio a través de la membrana luminal. La urea también se reabsorbe de forma pasiva del tú bulo, pero en un grado mucho menor que los iones cloro.

A medida que el agua se reabsorbe de los túbulos (por ósmosis acoplada a la reabsorción de sodio), la concentración de urea en la luz tubular aumenta. Esto crea un gradiente de concentración que favorece la reabsorción de urea. la reabsorción pasiva de la urea está facilitada por trasportadores específicos de la urea. A pesar de todo, sólo la mitad de la urea que se filtra por los capilares glomerulares se reabsorbe de los túbulos. El resto de la urea pasa a la orina, lo que permite a los riñones excretar grandes cantidades de este producto de desecho del metabolismo. Otro producto de desecho del metabolismo, la creatinina, es una molécula aún mayor que la urea y prácticamente no atraviesa la membrana tubular. Por tanto, casi nada de la creatinina filtrada se reabsorbe y casi toda la creatinina filtrada en el glomérulo se excreta en la orina.
REABSORCIÓN Y SECRECIÓN A LO LARGO DE DIFERENTS PARTES DE LA NEFRONA
Los principios básicos mediante los cuales se transportan a través de la membrana tubular el agua y los solutos.
REABSORCIÓN EN EL TÚBULO PROXIMAL
Alrededor del 65% de la carga filtrada de sodio y agua y algo menos del cloro filtrado se reabsorbe normalmente en el túbulo proximal antes de que el filtrado alcance el asa de Henle. Estos porcentajes pueden aumentar o disminuir en diferentes condiciones fisiológicas.

LOS TÚBULOS PROXIMALES TIENEN UNA ELEVADA CAPACIDAD DE REABSORCIÓN ACTIVA Y PASIVA
La elevada capacidad del túbulo proximal para la reabsorción se debe a sus características celulares especiales. Las células epiteliales tubulares proximales tienen un metabolismo alto y un gran número de mitocondrias para apoyar los potentes procesos de transporte activo. Además, las células tubulares proximales tienen un borde en cepillo extenso en el lado luminal (apical) de la membrana, así como un laberinto extenso de canales intercelulares y basales, todos los cuales proporcionan juntos una superficie de membrana extensa en los lados luminal y basolateral del epitelio para un transporte rápido de los iones sodio y de otras sustancias. La extensa superficie de membrana del borde en cepillo epitelial está también cargada de moléculas transportadoras proteicas que transportan una gran fracción de los iones sodio a través de la membrana luminal ligadas a un mecanismo de cotransporte de múltiples nutrientes orgánicos, como aminoácidos y glucosa. El sodio adicional se transporta desde a luz tubular hacia la célula por mecanismos de contratransporte, que reabsorben el sodio mientras secretan otras sustancias a la luz tubular, en especial iones hidrógeno.

(combinando H+ con HCO3– para formar H2CO3, que tiende a disociarse en H2O y CO2). Aunque la bomba ATPasa sodiopotasio es el principal medio para la reabsorción del sodio, el cloro y el agua a través del túbulo proximal,. En la primera mitad del túbulo proximal, el sodio se reabsorbe mediante cotransporte junto a la glucosa, los aminoácidos y otros solutos. Pero en la segunda mitad del túbulo proximal, poca glucosa y aminoácidos quedan por reabsorber. En cambio, el sodio se reabsorbe ahora sobre todo con iones de cloro. La segunda mitad del túbulo proximal tiene una concentración relativamente alta de cloro (alrededor de 140 mEq/l) comparada con la primera parte del túbulo proximal (unos 105 mEq/l), porque cuando se reabsorbe el cloro, se transporta preferentemente con glucosa, bicarbonato e iones orgánicos en la primera parte del túbulo proximal, dejando detrás una solución que contiene una mayor concentración de cloro. En la segunda mitad del túbulo proximal, la mayor concentración de cloro favorece la difusión de este ion desde la luz tubular a través de las uniones intercelulares hacia el líquido intersticial renal.
SECRECIÓN DE ÁCIDOS Y BASES ORGÁNICAS POR EL TÚBULO PROXIMAL
El túbulo proximal es también un lugar importante para la secreción de ácidos y bases orgánicos como las sales biliares, el oxalato, el urato y las catecolaminas. Son productos finales del metabolismo y deben eliminarse rápidamente del organismo. La secreción de estas sustancias en el túbulo proximal más la filtración en el túbulo proximal por los capilares glomerulares y la casi total falta de reabsorción por los tú bulos contribuyen, todos combinados, a su excreción rápida en la orina. Además de los productos de desecho del metabolismo, los riñones secretan muchos fármacos o toxinas potencialmente peligrosos directamente a través de las células tubulares hacia los túbulos y eliminan rápidamente estas sustancias de la sangre.

TRANSPORTE DE SOLUTOS Y AGUA EN LA ASA DE HENLE
El asa de Henle consta de tres segmentos con funciones diferentes: el segmento descendente fino, el segmento ascendente fino y el segmento ascendente grueso. Los segmentos descendente fino y ascendente fino, como sus nombres implican, tienen membranas epiteliales finas sin bordes en cepillo, pocas mitocondrias y niveles mínimos de actividad metabólica. La parte descendente del segmento fino es muy permeable al agua y moderadamente a la mayoría de los solutos, incluidos la urea y el sodio. La función de este segmento de la nefrona es sobre todo permitir la difusión simple de las sustancias a través de sus paredes. Alrededor del 20% del agua filtrada se reabsorbe en el asa de Henle, y casi todo esto ocurre en la rama descendente fina. La rama ascendente, incluidas las porciones fina y gruesa, es casi impermeable al agua, una característica que es importante para concentrar la orina.

El segmento grueso del asa de Henle, que comienza en la mitad de la rama ascendente, tiene células epiteliales gruesas que tienen una elevada actividad metabólica y son capaces de una reabsorción activa del sodio, el cloro y el potasio . También se reabsorben cantidades considerables de otros iones, como calcio, bicarbonato y magnesio, en la rama ascendente gruesa del asa de Henle. El segmento fino de la rama ascendente tiene un capacidad de reabsorción mucho menor que el segmento grueso y la rama descendente fina no reabsorbe cantidades significativas de ninguno de estos solutos. Un componente importante de la reabsorción de solutos en la rama ascendente gruesa es la bomba ATPasa sodiopotasio en las membranas basolaterales de la célula epitelial. Como en el túbulo proximal, la reabsorción de otros solutos en el segmento grueso del asa ascendente de Henle está muy ligada a la capacidad de reabsorción de la bomba ATPasa sodiopotasio, que mantiene una concentración intracelular baja de sodio. La baja concentración intracelular de sodio proporciona a su vez un gradiente favorable para el movimiento del sodio desde el líquido tubular hasta la célula. En el asa ascendente gruesa, el movimiento del sodio a través de la membrana luminal está mediado sobre todo por un cotransportador de 1sodio, 2cloro, 1potasio.

Esta proteína cotransportadora de la membrana luminal usa la energía potencial liberada por la difusión a favor de corriente del sodio hacia el interior de la célula para dirigir la reabsorción del potasio al interior de la célula frente al gradiente de concentración. La rama ascendente gruesa del asa de Henle es el lugar de acción de los poderosos diuréticos de «asa» furosemida, ácido etacrínico y bumetanida, todos los cuales inhiben la acción del cotransportador sodio 2cloro potasio. Estos diuréticos se comentan en el capítulo 31. La rama ascendente gruesa tiene también un mecanismo de contratransporte sodiohidrógeno en su membrana celular luminal que media la reabsorción de sodio y en la secreción de hidrógeno en este segmento. También tiene lugar una reabsorción paracelular significativa de cationes, como Mg++, Ca++, Na+ y K+, en la rama ascendente gruesa debido a la carga positiva ligera de la luz tubular respecto al líquido intersticial. Aunque el cotransportador 1sodio, 2cloro, 1potasio mueve igual cantidad de cationes y aniones al interior de la célula, hay una ligera retrodifusión de iones potasio a la luz, lo que crea una carga positiva de unos +8 mV en la luz tubular. Esta carga positiva fuerza a cationes, como el Mg++ y el Ca++, a difundir desde la luz tubular y a través del espacio paracelular hacia el líquido intersticial. El segmento grueso del asa ascendente de Henle es casi impermeable al agua. Luego la mayor parte del agua que llega a este segmento permanece en el túbulo, a pesar de la reabsorción de grandes cantidades de soluto. El líquido tubular en la rama ascendente se diluye mucho y fluye hacia el túbulo distal, una característica que es importante para permitir a los riñones diluir o concentrar la orina en diferentes condiciones
TÚBULO DISTAL
El segmento grueso de la rama ascendente del asa de Henle se vacía en el túbulo distal. La porción inicial del túbulo distal conforma la mácula densa, un grupo de células epiteliales densamente empaquetadas que es parte del complejo yuxtaglomerular que proporciona un control de retroalimentación del FG y del flujo sanguíneo en esta misma nefrona. La siguiente parte del túbulo distal está muy contorneada y cuenta con muchas de las características reabsortivas del segmento grueso de la rama ascendente del asa de Henle. Es decir, que reabsorbe con avidez la mayoría de los iones, incluidos el sodio, el potasio y el cloro, pero es casi to talmente impermeable al agua y a la urea. Por esta razón se le denomina segmento diluyente, porque también diluye el líquido tubular. Alrededor del 5% de la carga filtrada de cloruro de sodio se reabsorbe en la primera parte del túbulo distal.

El cotransportador sodiocloro mueve el cloruro de sodio desde la luz tubular hasta el interior de la célula, y la bomba ATPasa sodiopotasio transporta el sodio fuera de la célula a través de la membrana basolatera. El cloro se difunde fuera de la célula hacia el líquido intersticial renal a través de canales del cloro presentes en la membrana basolateral.
PORCIÓN FINAL DEL TÚBULO DISTAL Y TÚBULO COLECTOR CORTICAL
La segunda mitad del túbulo distal y el túbulo colector cortical situado a continuación tienen características funcionales similares. Están compuestos de dos tipos especiales de células, las células principales y células intercaladas . Las células principales reabsorben sodio y agua de la luz y secretan iones potasio a la luz. Las células intercaladas reabsorben iones potasio y secretan iones hidrógeno a la luz tubular.

LAS CÉLULAS REABSORBEN SODIO Y SECRETAN POTASIO
La reabsorción de sodio y la secreción de potasio por las células principales depende de la actividad de la bomba ATPasa sodiopotasio presente en la membrana basolateral de cada célula. Esta bomba mantiene una concentración baja de sodio dentro de la célula y, por tanto, favorece la difusión del sodio al interior de la célula a través de canales especiales. La secreción de potasio por estas células desde la sangre y hacia la luz tubular se hace en dos pasos: 1) el potasio entra en la célula por la acción de la bomba ATPasa sodiopotasio, que mantiene una concentración intracelular de potasio alta, y 2) una vez en la célula, el potasio se difunde siguiendo su gradiente de concentración a través de la membrana luminal hacia el líquido tubular. Las células principales son los primeros lugares de acción de los diuréticos ahorradores de potasio, como espironolactona, eplerenona, amilorida y triamtereno. Los antagonistas de los receptores de espironolactona y eplerenona compiten con la aldosterona por sus receptores en las células principales y por tanto inhiben los efectos estimuladores de esta hormona sobre la reabsorción de sodio y la secreción de potasio. La amilorida y el triamtereno son bloqueantes de los canales del sodio que inhiben directamente la entrada del sodio en los canales del sodio de las membranas luminales y así reducen la cantidad de sodio que puede transportarse a través de las membranas basolaterales por medio de la bomba ATPasa sodiopotasio. Esto reduce a su vez el transporte de potasio al interior de las células y disminuye finalmente la secreción de potasio al líquido tubular. Por esta razón, los bloqueantes de los canales del sodio y los antagonistas de la aldosterona reducen la excreción urinaria de potasio y actúan como diuréticos ahorradores de potasio.

LAS CÉLULAS INTERCALADAS SECRETAN IONES HIDRÓGENO Y REABSORBEN IONES BICARBONATO
La secreción de iones hidrógeno en las células intercaladas está mediada por un transportador hidrógenoATPasa. El hidrógeno se genera en esta célula por la acción de la anhidrasa carbónica sobre el agua y el dióxido de carbono para formar ácido carbónico, que después se disocia en iones hidrógeno y bicarbonato. Los iones hidrógeno se secretan después hacia la luz tubular, y por Figura cada ion hidrógeno secretado queda disponible un ion bicarbonato para su reabsorción a través de la membrana basolateral.Las células intercaladas también pueden reabsorber iones potasio.
Las características funcionales de la porción final del túbulo distal y del túbulo colector cortical pueden resumirse como sigue:
1. Las membranas tubulares de los dos segmentos son casi completamente impermeables a la urea, de forma similar al segmento diluyente de la primera parte del túbulo distal; luego casi toda la urea que entra en estos segmentos atraviesa el túbulo colector para su excreción en la orina, aunque se produce una cierta reabsorción de urea en los conductos colectores medulares.
2. La porción final del túbulo distal y el túbulo colector cortical reabsorben iones sodio y su intensidad está controlada por hormonas, en especial por la aldosterona. Al mismo tiempo, estos segmentos secretan iones potasio desde la sangre capilar peritubular hacia la luz tubular, un proceso que también está controlado por la aldosterona y otros factores como la concentración de iones potasio en los líquidos corporales.
3. Las células intercaladas de estos segmentos de la ne frona secretan ávidamente iones hidrógeno mediante un mecanismo hidrógenoATPasa.
4. La permeabilidad al agua de la porción final del túbulo distal y del conducto colector cortical está controlada por la concentración de ADH, que también se llama vasopresina. Con concentraciones altas de ADH, estos segmentos tubulares permanecen permeables al agua, pero sin ADH son prácticamente impermeables a ella. Esta característica especial proporciona un importante mecanismo de control del grado de dilución o concentración de la orina 1.000 a 1.
EL COCIENTE ENTRE LA CONCENTRACIÓN DE INUOINA EN LÍQUIDO TUBULAR/PLASMA PUEDE SERVIR PARA MEDIR LA REABSORCIÓN DE AGUA EN LOS TÚBULOS RENALES
La inulina, un polisacárido usado para medir el FG, no se reabsorbe ni se secreta en los túbulos renales. Los cambios en la concentración de inulina en diferentes puntos a lo largo del túbulo renal reflejan, por tanto, cambios en la cantidad de agua presente en el líquido tubular. Como la inulina no se secreta ni se reabsorbe de los túbulos, un cociente entre la concentración en líquido tubular/plasma de 3 significa que sólo un tercio del agua que se ha filtrado permanece en el túbulo renal y que dos terceras partes del agua filtrada se han reabsorbido a medida que el líquido ha pasado por el túbulo proximal. Al final de los conductos colectores, el cociente entre la concentración de inulina en líquido tubular/plasma aumenta a alrededor de 125 , lo que indica que sólo 1/125 del agua filtrada permanece en el túbulo y que más del 99% se ha reabsorbido.

REGULACIÓN DE LA REABSORCIÓN TUBULAR
Debido a que es esencial mantener un equilibrio preciso entre la reabsorción tubular y la filtración glomerular, hay múltiples mecanismos de control nerviosos, hormonales y locales que regulan la reabsorción tubular, así como los hay para el control de la filtración glomerular. Una característica importante de la reabsorción tubular es que la reabsorción de algunos solutos puede regularse independientemente de la de otros, en especial mediante mecanismos de control hormonal.

EQUILIBRIO GLOMERULOTUBULAR: LA CAPACIDAD DE LOLS TÚBULOS DE AUMENTAR LA REABSORCIÓN EN RESPUESTA A UN INCREMENTO DE LA CARA TUBULAR
Uno de los mecanismos más básicos de control de la reabsorción tubular es la capacidad intrínseca de los túbulos de aumentar su reabsorción en respuesta a una mayor carga tubular (un aumento del flujo tubular). Este fenómeno se denomina equilibrio glomerulotubular. Por ejemplo, si el FG aumenta de 125 ml/min a 150 ml/min, el grado de reabsorción tubular absoluta aumenta también de unos 81 ml/min (65% del FG) a unos 97,5 ml/min (65% del FG). Luego el equilibrio glomerulotubular se refiere al hecho de que la reabsorción aumenta a medida que lo hace la carga filtrada, incluso cuando el porcentaje reabsorbido del FG en el tú bulo proximal permanece relativamente constante alrededor de un 65%. También se produce algún grado de equilibrio glomerulotubular en otros segmentos tubulares, en especial en el asa de Henle.

Los mecanismos del equilibrio glomerulotubular pueden ser independientes de las hormonas y pueden demostrarse en riñones completamente aislados o incluso en segmentos de túbulo proximal completamente aislados. El equilibrio glomerulotubular ayuda a evitar sobrecargas en segmentos del túbulo distal cuando el FG aumenta. El equilibrio glomerulotubular actúa como segunda línea de defensa para amortiguar los efectos de los cambios espontáneos en el FG sobre la diuresis. (La primera línea de defensa, comentada antes, comprende los mecanismos autorreguladores renales, en especial la retroalimentación tubuloglomerular, que ayuda a evitar cambios en el FG.)
FUERZAS FÍSICAS EN EL LÍQUIDO CAPILAR PERITUBULAR Y EL LÍQUIDO INTERSTICIAL
Las fuerzas hidrostática y coloidosmótica gobiernan el grado de reabsorción a través de los capilares peritubulares, a la vez que controlan la filtración en los capilares glomerulares. Los cambios en la reabsorción capilar peritubular pueden a su vez influir en las presiones hidrostática y coloidosmótica del intersticio renal y, finalmente, en la reabsorción del agua y los solutos desde los túbulos renales.
VALORES NORMALES DE LAS FUERZAS FÍSICAS Y DE LA INTENSIDAD DE LA REABSORCIÓN
A medida que el filtrado glomerular pasa a través de los túbulos renales, más del 99% del agua y la mayoría de los solutos se reabsorben normalmente. El líquido y los electrólitos se reabsorben desde lo túbulos hacia el intersticio renal y desde allí a los capilares peritubulares. La reabsorción capilar peritubular normal es de unos 124 ml/min. La reabsorción a través de los capilares peritubulares puede calcularse como
Reabsorción = Kf × Fuerza de reabsorción neta
La fuerza de reabsorción neta representa la suma de las fuerzas hidrostática y coloidosmótica que favorecen o se oponen a la reabsorción a través de los capilares peritubulares. Estas fuerzas son: 1) la presión hidrostática dentro de los capilares peritubulares (presión hidrostática peritubular [Pc]), que se opone a la reabsorción; 2) la presión hidrostática en el intersticio renal (Pli) fuera de los capilares, que favorece la reabsorción; 3) la presión coloidosmótica de las proteínas plasmáticas en el capilar peritubular (πc), que favorece la reabsorción, y 4) la presión coloidosmótica de las proteínas en el intersticio renal (πli), que se opone a la reabsorción.
PRESIONES HIDROSTÁTICA Y COLOIDOSMÓTICA EN EL INTERSTICIO RENAL.
Los cambios en las fuerzas físicas capilares peritubulares influyen en la reabsorción tubular al cambiar las fuerzas físicas en el intersticio renal que rodea a los túbulos. Por ejemplo, un descenso en la fuerza de reabsorción a través de las membranas capilares peritubulares, causado por un aumento de la presión hidrostática capilar peritubular o un descenso de la presión coloidosmótica capilar peritubular, reduce la captación de líquido y solutos desde el intersticio hacia los capilares peritubulares. Esto a su vez aumenta la presión hidrostática del líquido intersticial renal y reduce la presión coloidosmótica en el líquido intersticial debido a la dilución de las proteínas en el intersticio renal. Estos cambios reducen después la reabsorción neta de líquido desde los túbulos renales hacia el intersticio, en especial en los túbulos proximales.

Una vez que los solutos entran en los canales intercelulares o en el intersticio renal mediante transporte activo o difusión pasiva, el agua pasa desde la luz tubular al intersticio por ósmosis. Y una vez que el agua y los solutos están en los espacios intersticiales, pueden ser barridos a los capilares peritubulares o difundirse a través de las uniones epiteliales hacia la luz tubular. Las también conocidas como uniones estrechas entre las células epiteliales del túbulo proximal permiten en realidad filtraciones, de manera que cantidades considerables de sodio pueden difundir en ambas direcciones a través de estas uniones. Con la intensidad normal alta de reabsorción capilar peritubular, el movimiento neto de agua y de solutos está dentro de los capilares peritubulares con poca retrodifusión a la luz del túbulo. Pero cuando se reduce la reabsorción capilar peritubular, hay un aumento de la presión hidrostática del líquido intersticial y una tendencia a que mayores cantidades de solutos y de agua re tro difundan a la luz tubular lo que reduce la reabsorción neta .
EFECTO DELA PESIÓN ARTERIAL SOBRE LA DIURESIS:PRESIÓN-NATRIURESIS Y PRESIÓN-DIURESIS
Incluso pequeños incrementos en la presión arterial pueden provocar aumentos en la excreción urinaria de sodio y agua, fenómenos que se conocen como natriuresis por presión y diuresis por presión. El aumento de la presión arterial entre los límites de 75 y 160 mmHg suele tener sólo un efecto pequeño sobre el flujo sanguíneo renal y el FG. El ligero incremento del FG que se produce contribuye en parte al efecto del aumento de la presión arterial sobre la diuresis. Cuando la autorregulación del FG está deteriorada, como ocurre a menudo en las nefropatías, el aumento de la presión arterial da lugar a incrementos mucho mayores del FG. Un segundo efecto del aumento de la presión arterial renal que incrementa la diuresis es que reduce el porcentaje de la carga filtrada de sodio y agua que reabsorben los túbulos.

Los mecanismos responsables de este efecto son un ligero incremento en la presión hidrostática capilar peritubular, en especial en los vasos rectos de la médula renal, y un posterior aumento de la presión hidrostática en el líquido intersticial renal. Como se comentó antes, un aumento en la presión hidrostática en el líquido intersticial renal favorece la retrodifusión de sodio a la luz tubular, lo que reduce la reabsorción neta de sodio y agua y aumenta aún más la diuresis cuando la presión arterial aumenta. Un tercer factor que contribuye a los mecanismos de presiónnatriuresis y presióndiuresis es la menor formación de angiotensina II. La propia angiotensina II aumenta la reabsorción de sodio en los túbulos; también estimula la secreción de aldosterona, lo que aumenta la reabsorción de sodio. Luego, la reducción de la angiotensina II contribuye a la menor reabsorción tubular de sodio que tiene lugar cuando aumenta la presión arterial.
CONTROL HORMONAL DE LA REABSORCIÓN TUBULAR
La regulación precisa de los volúmenes y concentraciones de solutos en los líquidos corporales exige que los riñones excreten los diferentes solutos y agua con una intensidad variable a veces independientemente unos de otros. Por ejemplo, cuando aumenta la ingestión de potasio, los riñones deben excretar más potasio manteniendo una excreción normal de sodio y electrólitos. Además, cuando cambia la ingestión de sodio, los riñones deben ajustar adecuadamente su excreción en la orina sin cambiar mucho la excreción de otros electrólitos. Varias hormonas del organismo proporcionan esta especificidad a la reabsorción tubular para diferentes electrólitos y agua
.

LA ALDOSTERONA AUMENTA LA REABSORCION DE SODIO Y ESTIMULA LA SECRECIÓN DE POTASIO
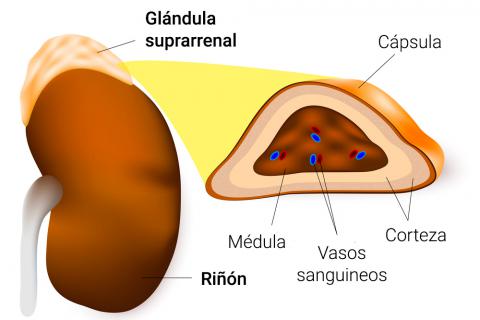
La aldosterona, que secretan las células de la glomerulosa de la corteza suprarrenal, es un regulador importante de la reabsorción de sodio y la secreción de potasio en los túbulos renales. Un lugar de acción tubular renal importante de la aldosterona son las células principales del túbulo colector cortical. El mecanismo por el cual la aldosterona aumenta la reabsorción de
sodio mientras incrementa a la vez la secreción de potasio es estimulando la bomba ATPasa sodiopotasio en el lado basolateral de la membrana del túbulo colector cortical. La aldosterona también aumenta la permeabilidad al sodio del lado luminal de la membrana.

Los estímulos más importantes para la aldosterona son: 1) aumento de la concentración extracelular de potasio y 2) aumento de los niveles de angiotensina II, que normalmen te aparecen en trastornos asociados con la depleción de sodio y de volumen o la baja presión arterial. El aumento de la secreción de aldosterona asociado con estos trastornos provoca retención renal de sodio y agua, lo que ayuda a aumentar el volumen de líquido extracelular y a restaurar la presión arterial a valores normales. Sin aldosterona, como ocurre en la destrucción o mala función de la glándula suprarrenal (enfermedad de Addison), hay una pérdida acentuada de sodio y una acumulación de potasio en el organismo. Por el contrario, el exceso de secreción de aldosterona, como ocurre en los pacientes con tumores suprarrenales (síndrome de Conn) se acompaña de una retención de sodio y una disminución de potasio en plasma debida, en parte, a una excesiva secreción de potasio por los riñones.
LA ANGIOTENSINA II AUMENTA LA REABSORCIÓN DE SODIO Y DE AGUA
La angiotensina II es quizás la hormona ahorradora de sodio más potente del organismo.La formación de angiotensina II aumenta en circunstancias asociadas a una presión arterial baja o un volumen de líquido extracelular bajo, como durante la hemorragia o la pérdida de sal y agua de los líquidos corporales por sudoración excesiva o una diarrea intensa. La mayor formación de angiotensina II ayuda a normalizar la presión arterial y el volumen extracelular al aumentar la reabsorción de sodio y agua en los túbulos renales a través de tres efectos principales: 1. La angiotensina II estimula la secreción de aldosterona, lo que a su vez aumenta la reabsorción de sodio. 2. La angiotensina II contrae las arteriolas eferentes, lo que tiene dos efectos sobre la dinámica capilar peritubular que aumentan el sodio y el agua. Primero, la constricción arteriolar reduce la presión hidrostática capilar peritubular, lo que aumenta la reabsorción tubular neta, en especial en los túbulos proximales. Segundo, la constricción arteriolar eferente, al reducir el flujo sanguíneo, aumenta la fracción de filtración en el glomérulo y también la concentración de proteínas y la presión coloidosmótica en los capilares peritubulares; esto incrementa la fuerza de reabsorción en los capilares peritubulares y la reabsorción tubular de sodio y agua. 3. La angiotensina II estimula directamente la reabsorción de sodio en los túbulos proximales, las asas de Henle, los túbulos distales y los túbulos colectores. Uno de los efectos directos de la angiotensina II es estimular la bomba ATPasa sodiopotasio en la membrana basocelular de la célula epitelial tubular. Un segundo efecto es estimular el intercambio de sodio por hidrógeno en la membrana luminal, en especial en el túbulo proximal Un tercer efecto de la angiotensina II consiste en estimular el cotransporte de bicarbonatosodio en la membrana basolateral . Luego la angiotensina II estimula el transporte de sodio a través de las superficies luminal y basolateral de la membrana de la célula epitelial en la mayoría de los segmentos tubulares renales. Estas múltiples acciones de la angiotensina II provocan una retención acentuada de sodio y agua por los riñones cuando aumentan las concentraciones de angiotensina II y desempeñan una función crítica para permitir que el organismo se adapte a amplias variaciones en la ingestión de sodio sin grandes cambios en el volumen de líquido extracelular y presión arterial. Al mismo tiempo que la angiotensina II aumenta la reabsorción de sodio tubular renal, su efecto vasoconstrictor en las arteriolas eferentes también ayuda al mantenimiento de la excreción normal de productos de desecho metabólicos como la urea y la creatinina que dependen principalmente de un FG adecuado para su excreción. Así, el aumento en la formación de angiotensina II permite que los riñones retengan sodio y agua sin provocar la retención de productos metabólicos de desecho.

La ADH AUMENTA LA REABSORCIÓN DE AGUA
La acción renal más importante de la ADH es aumentar la permeabilidad al organismo del epitelio del túbulo distal, el túbulo colector y el conducto colector. Este efecto ayuda al organismo a conservar el agua en circunstancias como la deshidratación. Sin ADH, la permeabilidad al agua de los túbulos distales y de los conductos colectores es baja, lo que hace que los riñones excreten grandes cantidades de orina diluida. Luego las acciones de la ADH desempeñan una función clave en el control del grado de dilución o concentración de la orina, como se comenta con más detalle en los capítulos 28 y 75. La ADH se une a receptores V2 específicos situados en la última parte de los túbulos distales, los túbulos colectores y los conductos colectores y aumenta la formación de AMP cíclico y activa las proteína cinasas (fig. 2718). Esto estimula a su vez el movimiento de una proteína intracelular, llamada acuaporina2 (AQP2), hacia el lado luminal de las membranas celulares. Las moléculas de AQP2 se agrupan y se fusionan con la membrana celular por exocitosis hasta formar canales de agua, que permiten una rápida difusión del agua a través de las células. Hay otras acuaporinas, AQP3 y AQP4, en el lado basolateral de la membrana celular que proporcionan una vía de salida rápida al agua, aunque se cree que estas no están reguladas por la ADH. El aumento mantenido de la ADH aumenta la formación de la proteínas AQP2 en las células tubulares renales al estimular la transcripción del gen de la AQP2. Cuando la concentración de AQP2 se reduce, las moléculas de AQP2 son lanzadas de nuevo al citoplasma de la célula, lo que retira los canales de agua de la membrana luminal y reduce la permeabilidad al agua.
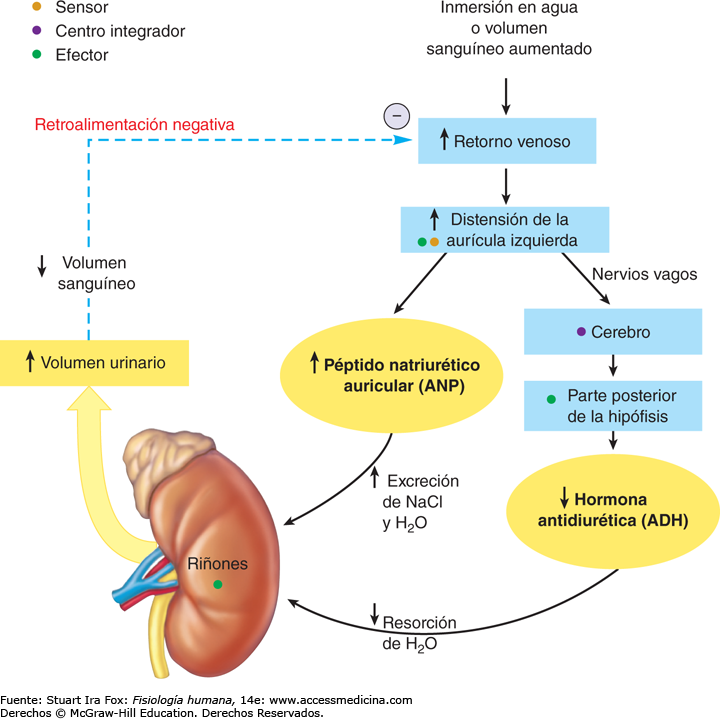
El PÉPTIDO NATRIURÉTICO AURICULAR REDUCE LA REABSORCIÓN DE SODIO Y AGUA
Células específicas de las aurículas cardíacas, cuando se distienden debido a una expansión del plasma, secretan un péptido llamado péptido natriurético auricular (ANP). Las concentraciones elevadas de este péptido inhiben a su vez directamente la reabsorción del sodio y del agua en los túbulos renales, en especial en los conductos colectores. El ANP inhibe también la secreción de renina y, por tanto, la formación de angiotensina II, lo que a su vez reduce la reabsorción tubular renal. Esta menor reabsorción del sodio y del agua aumenta la excreción urinaria, lo que ayuda a normalizar el volumen sanguíneo. Los niveles de ANP están altamente elevados en insuficiencia cardíaca congestiva cuando las aurículas cardíacas se extienden debido a un deterioro en el bombeo de los ventrículos. El aumento de ANP ayuda a atenuar la retención de sodio y agua en insuficiencia cardíaca.
LA ACTIVACIÓN DEL SISTEMA NERVIOSO SIMPÁTICO AUMENTA LA REABSORCIÓN DE SODIO
La activación del sistema nervioso simpático, cuando es grave, puede reducir la excreción de agua y de sodio al contraer las arteriolas renales, lo que reduce el FG. Incluso niveles bajos de activación simpática reducen, sin embargo, la excreción de sodio y agua mediante un aumento de la reabsorción de sodio en el túbulo proximal, la rama ascendente gruesa del asa de Henle y quizás en partes más distales del túbulo renal. Esto sucede por activación de receptores aadrenérgicos en las células epiteliales tubulares renales. La estimulación del sistema nervioso simpático aumenta la liberación de renina y la formación de angiotensina II, lo que contribuye al efecto global de aumento de la reabsorción tubular y reducción de la excreción renal de sodio.
























































































































/s3.amazonaws.com/arc-wordpress-client-uploads/infobae-wp/wp-content/uploads/2017/02/08202242/o-ELEPHANTIASIS-facebook.jpg)